即使是最简单的细胞,其内部结构也是高度有序的:细胞的各个成分必须能够自我组装并形成高度组织化的结构,才能使细胞正常运作。而且,细胞的内容物始终处于持续运动之中。
最显而易见的运动由“马达蛋白”催化——这些酶利用 ATP 水解的能量执行多种任务,包括:将离子泵送穿过质膜、将大型复合物从一个细胞内部位置运输到另一个位置,以及推动细胞在环境中移动。
在细胞尺度上(其直径可小至 1 微米,即 10⁻⁶ 米),分子(包括水分子)的随机热运动非常显著。这种自发的运动称为热运动或布朗运动(Brownian motion),最早由罗伯特·布朗(Robert Brown)于 1827 年在显微镜下观察到——当时他看到悬浮在水中的花粉颗粒在不断地抖动。这种由随机分子碰撞引起的持续波动运动具有重要的影响。布朗运动驱动了扩散(diffusion)过程,并决定了细胞内部生化反应的速率,因为分子间的碰撞频率直接影响反应发生的速度。
尽管布朗运动是随机的,细胞仍能加以利用,使之为己所用。例如,在动物细胞的爬行迁移过程中,细胞前缘的质膜会向前延伸。这一运动并不依赖马达蛋白,而是通过细胞骨架中的肌动蛋白丝(actin filament)在膜内表面附近聚合来实现的。当质膜因热运动向前波动时,新的肌动蛋白单体会迅速填补产生的空隙,使膜无法退回原位。这种现象即为利用随机热运动来产生定向效果的过程,称为布朗棘轮机制(Brownian ratchet)。
由于处于微米尺度的物体不断受到水分子的冲击,其运动必须克服巨大的粘滞阻力。因此,当细胞内某个分子复合体(例如由马达蛋白驱动)发生定向运动时,一旦马达蛋白停止作用,这种运动便会立即终止,复合体会重新被随机的热运动所扰动。在细胞内部,不存在“滑行”式的运动。
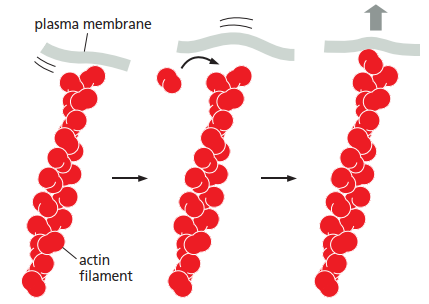
图:《Molecular Biology of the Cell》7E Figure 1–7
图中显示一条单一的肌动蛋白(actin)丝紧贴在质膜上。由于随机的热运动,质膜不断地前后波动。当质膜偶然向远离丝端的方向移动时,就会在丝端和膜之间产生足够的空间,使一个新的肌动蛋白亚基能够迅速加到丝的末端。这样稍微变长的丝就像一个棘轮一样,阻止质膜回到原来的位置。
在迁移中的动物细胞中,这种布朗棘轮机制推动膜向前突起,从而促进细胞的前进运动。