代谢寡糖工程 #242
自1990年代末,代谢寡糖工程(MOE, metabolic oligosaccharide engineering)试剂问世以来,人们就可以从新的角度审视糖组(glycome)[135]。这些生物正交基团非常适合现代化学蛋白质组学技术 [6]。目前大多数方法依赖含生物素(biotin)的可点击(clickable)手柄,用于糖肽在质谱分析前的富集。为了特异性富集糖肽,通常会采用基于中性亲和素(neutravidin)的树脂蛋白酶消化策略,以去除非糖基化肽段。
Tirrell 等人[112,113,126,127]开发的生物素-吡啶丙炔叠氮(biotin-picolyl azide)试剂中,包含一个额外的酸可裂解的二苯基二硅氧烷(diphenyldisiloxane)基团 ,其后被成功应用于糖蛋白组学研究。这一生物正交手柄在数据采集和验证过程中提供了显著优势:在高能碰撞解离(HCD)过程中出现了新的指纹离子(fingerprint ions),可用于触发电子转移解离(ETD)。在ETD谱图中,还出现了一个m/z为194的特征离子,可用于验证谱图,并作为搜索算法中用于提高糖链注释置信度的依据 [11]。
Bump-and-hole (BH) engineering
“bump-and-hole(BH)”工程的核心内容是研究某一糖基转移酶家族中单个成员的产物。在结构导向的设计中,通过将酶活性口袋中体积较大的“门控”(gatekeeper)氨基酸突变为更小的氨基酸,来扩展其催化口袋,从而构建出 BH 突变体。这种策略在酶活性位点中创造出一个通常为疏水性的“孔洞”(hole),与一个含有体积较大“突起”(bump)官能团的合成底物形成互补(图)。由于这个“突起”底物只能被 BH 突变酶识别,因此这种新构建的酶–底物对在如活细胞这样的复杂体系中具有正交性。
自从 Alaimo 等人及 Shokat 团队首先将该策略应用于激酶研究[
15],随后这一方法在多个酶家族中取得成功[
16,
17,
18,
19,
20,
21,
22,
23,
24],为其在糖科学领域中应用于糖基转移酶(GTs)奠定了基础。
GT BH 工程的早期探索
2000 年初,Qasba 和 Ramakrishnan 首次对一种糖基转移酶进行了工程化改造,使其可接受非天然、生物正交的尿苷二磷酸(UDP)糖底物 [25]。牛源 β-1,4-半乳糖基转移酶(B4GalT1)通常将半乳糖转移到 N-乙酰氨基葡萄糖(GlcNAc)末端结构上。将酶中的 Tyr298 突变为 Leu,使 BH-B4GalT1 能够催化诸如 UDP-2-酮-半乳糖和 UDP-叠氮-N-乙酰半乳糖胺1(UDP-GalNAz)等 UDP-GalNAc 衍生物(图 1d)[26, 27, 28]。然而,这些底物并不够大,不足以被认为是“突起”结构,因此许多野生型糖基转移酶(WT-GTs)也可以使用这些底物[14,29]。
此外,胞质中的 UDP-GalNAc/GlcNAc 4'-表异构酶 GALE 会将 UDP-GalNAz 转化为相应的 UDP-GlcNAc 衍生物(UDP-GlcNAz) [14]。因此,BH-B4GalT1/UDP-GalNAz 并不适合在活细胞中使用。尽管如此,通过 Hsieh-Wilson 等人的努力,该系统已被开发成一种体外分析核-胞质内 Ser/Thr-O-GlcNAc 修饰蛋白的工具 [30, 31, 32, 33∗, 34, 35]。
重编程代谢以递送 UDP-GalNAc 衍生物至活细胞
Reprogramming metabolism to deliver UDP-GalNAc analogs into living cells
要在细胞中实现GT BH 工程,需要在胞质中合成“突起”(bumped ) UDP-糖底物。
Piller 等人 [36] 发现,GalNAc 回收通路中的激酶 GALK2 和焦磷酸化酶 AGX1 对 GalNAc 的酰胺侧链修饰的底物容忍性较低(图),因此“突起”GalNAc 衍生物无法有效作为其底物 [11,12,37]。由于 AGX1 及其同源酶 AGX2 也是 GlcNAc 回收通路的组成部分,其底物特异性低限制了“突起”UDP-GalNAc 和 UDP-GlcNAc 衍生物的合成。
此时,蛋白质工程再次发挥作用。Kohler 等人将 AGX1 中的门控残基 Phe381 或 Phe383 突变为 Gly,并测试其对“突起”GlcNDAz-1-磷酸底物的加工能力(图)[43]。
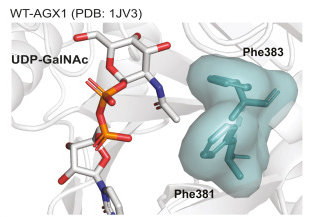
Co-crystal structure of WT-AGX1 with UDP-GalNAc (PDB 1JV3) used to rationalize the F383G/A mutation that biosynthesizes bumped UDP-sugar analogs.
突变体 AGX1F383G 随后被用于使细胞能够合成 UDP-GlcNDAz 2(图c)。
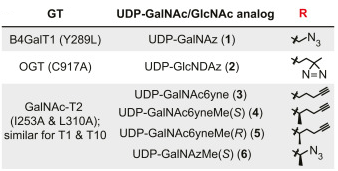
Structures of UDP-sugar analogs used in conjunction with GT engineering.
为绕过 GALK2 的限制,研究者使用了可渗透膜、带保护基的 GlcNDAz-1-磷酸前体进行递送。最终,GlcNDAz 被用于 O-GlcNAc 修饰的光交联标记,从而实现了通过质谱(MS)蛋白质组学技术绘制蛋白互作图谱,并与 O-GlcNAc 转移酶(OGT)的 BH 工程联合使用 [38]。
人类糖基转移酶(GT)家族的“bump-and-hole”(BH)工程
对整个人类糖基转移酶(GT)家族进行“bump-and-hole”(BH)工程改造的尝试始于2000年代初^[by C. R. Bertozzi],但直到近二十年后才得以实现。
多肽GalNAc转移酶(GalNAc-Ts)是人类基因组中规模最大的GT家族之一。大约有20种同工酶(isoenzymes,T1-T20)催化由GalNAcα1-O-Ser/Thr(也称为O-GalNAc或黏蛋白型糖基化)启动的糖链生物合成的第一步。
尽管已有研究将GalNAc-Ts与多种疾病相关联 [2,39, 40, 41, 42],但由于其在分泌通路中复杂的相互作用,仍难以将特定的同工酶与明确的生物学功能对应起来。
BH策略独特地适用于剖析GalNAc-T的生物学功能,但在Qasba、Hsieh-Wilson、Bertozzi、Kohler及其他研究者的开创性工作满足一系列关键前提之前,该方法并不适用于GalNAc-T家族。
BH方法需要酶-底物共晶结构(co-crystal structure),Narimatsu等人首次报道了GalNAc-T10与GalNAc的共晶结构[43]。通过结构和序列同源性分析,研究人员识别出闸门残基(gatekeeper residues)Ile和Leu,并将其映射至其他同工酶(见图3a与b)。
其次,为了在体外识别合适的BH酶-底物对,需要生物正交(bioorthogonal)且带有“bump”的UDP-GalNAc类似物。Choi、Wagner等人[44] 结合化学与酶促合成方法开发出20种UDP-GalNAc类似物。将两个闸门残基突变为Ala可重新编程野生型(WT)GalNAc-T1、T2和T10对化学修饰的UDP-GalNAc类似物(如烷炔类3–5)的底物特异性(见图3a、c)。
随后,我们发现这种工程保留了T2的三维结构以及T1与T2对肽底物的选择性 [11],确认了BH-GalNAc-Ts具有类似WT的行为特征(见图3d)。
图3. GalNAc-T “bump-and-hole”工程的结构基础:
(a) 在GalNAc-T1 (PDB
1XHB), T2 (PDB
4D0T), T4 (PDB
5NQA), T7 (PDB
6IWR)和 T10 (PDB
2D7I)晶体结构中识别出的闸门残基。
(b) 所有20种GalNAc-Ts中闸门残基的序列比对。
(c) BH-GalNAc-T2与UDP-GalNAc6yne 3的共晶结构(PDB
6NQT),其中闸门残基突变为Ala以容纳脂肪族烷炔。
(d) WT-GalNAc-T2(PDB
2FFU)与BH-GalNAc-T2(PDB
6E7I)及其EA2底物肽、Mn²⁺和UDP的重叠结构。
(e) 在细胞中转染AGX1(WT或突变型)及GalNAc-T1或T2(WT或BH突变体)后进行代谢标记。使用Dox诱导GalNAc-T表达,并投喂UDP-GalNAc6yne 3的保护前体。DMSO与带标签的唾液酸前体Ac4ManNAl分别作为阴性与阳性对照。图e转载自《Molecular Cell》Vol 78/5,B. Schumann等人《Bump-and-Hole Engineering Identifies Specific Substrates of Glycosyltransferases in Living Cells》,第824–834.e15页,版权归Elsevier所有。
随后,研究者在活细胞中构建了一个GalNAc-T的BH系统。该策略采用Kohler团队开发的AGX1介导底物递送系统。通过使用突变型AGX1 F383A,研究者将UDP-GalNAc类似物3由细胞可渗透、保护状态的GalNAc-1-磷酸类似物Ac3GalNAc6yne-1-P(SATE)₂转运至细胞中,该前体可在胞质中被酯酶与硫酯酶去保护(见图1、图2a)。值得注意的是,AGX1 F383A突变体与F383G有相似性能,但在我们实验中对更广泛的GalNAc-1-磷酸类似物具有接受能力,本文称之为“mut-AGX1”(见图2a)[12]。此时通过离子交换色谱监测细胞提取物中的UDP-糖合成是验证底物递送的关键步骤。免疫荧光进一步显示BH-T1与BH-T2定位于高尔基体,其表达可通过多西环素(doxycycline, Dox)诱导的启动子调控(见图3e)。
在成功递送“bump”底物和表达BH-GalNAc-T的前提下,研究人员开始检测GalNAc类似物是否被整合进细胞表面的糖链中。使用烷炔(alkyne)作为生物正交标签并非没有限制,因为其反应依赖于CuAAC而非SPAAC[6]。Wu等人开发了可在活细胞表面进行CuAAC反应的生物相容性铜(I)配体 [45, 46]。Ting等人设计的吡啶基叠氮(picolyl azide)衍生物[47] 进一步加速CuAAC反应,并用于通过流式细胞术和凝胶内荧光检测鉴定由个别GalNAc-T催化修饰的细胞表面糖链(见图3e)。在功能性BH系统存在的条件下,荧光信号显著增强,且GalNAc-T1与T2标记的糖蛋白带型大体重叠。质谱(MS)蛋白质组学分析表明这些糖蛋白富含O-糖基化的黏蛋白结构域,是T1和T2的潜在底物[11]。不过,T1与T2标记带型间某些可重复的差异说明某些底物可能只由特定同工酶修饰。
值得一提的是,AGX1F383A与BH-GalNAc-Ts对有效标记的双重依赖性,使我们能够评估在缺乏其中任一酶时的背景信号。因此,我们排除了某些化学代谢标记(MOE)试剂在特定条件下通过消除-加成反应引起的非特异性荧光信号,从而验证了策略的可靠性(见图3e)[48]。
相比之下,在缺乏BH-GalNAc-T表达的条件下,仅通过AGX1途径合成bump型UDP-GalNAc类似物3时,检测到明显背景信号。核苷酸-糖分析表明,其中一小部分3被酶GALE催化为对应的UDP-GlcNAc类似物。
我们推测N-连接糖链是GlcNAc类似物在细胞表面的主要定位,因此使用脱N-糖苷酶PNGase F处理细胞裂解液后,显著降低了背景标记。在未诱导BH-GalNAc-T表达的条件下,荧光信号接近背景,确认BH-GalNAc-T系统适用于K-562细胞(见图3e)。我们后续还发现,通过引入支链酰胺(branched acylamide)侧链,可使UDP-GalNAc衍生物抗表异构化(epimerization)(见图2a),从而获得选择性用于O-GalNAc糖链探针UDP-GalNAzMe 6(见图2c)[12]。
BH策略可用于构建针对单一GalNAc-T活性的功能增强型(gain-of-function)标记工具,并与糖蛋白质组学流程结合,提供直接分析GalNAc-T特异性糖基化位点的独特机会。
借助化学糖蛋白组学与BH(“gain-of-function”突变体)工程策略相结合的优势,研究人员成功绘制了由两个GalNAc-T同工酶引发的糖基化位点图谱。他们使用了缺失内源性T1或T2表达的HepG2细胞,并分别回补表达了BH-T1或BH-T2 [128]。在细胞合成UDP-GalNAc类似物3的过程中,成功识别出由不同GalNAc-T同工酶引发的差异糖基化位点。其中一些位点与 Schjoldager 等人基于 SimpleCells 模型提出的特异性位点相符,从而验证了该策略的有效性,而另一些位点则是新发现。
BH策略还带来了两个此前难以获得的重要数据:(i)解决了载脂蛋白AI(Apolipoprotein AI)糖基化位点是否为GalNAc-T特异性的争议,此前由于GalNAc-T家族中酶的功能代偿与竞争,相关数据一直模糊不清;(ii)所使用的化学修饰GalNAc类似物被进一步延伸修饰为四糖结构(Neu5Ac)₂-Hex-GalNAc,对应HepG2细胞中最丰富的O-GalNAc糖链类型——双唾液酸T抗原(di-Sialyl-T antigen)[129]。
由于生物素化的富集策略本身对糖链结构不具选择性,因此该方法有潜力实现糖基修饰位点与糖链结构分析的联合研究,这在糖蛋白组层面仍是一项技术挑战,但前景极具吸引力。