起初很难接受生命仅仅是化学系统的观点。直到十九世纪末,人们都还认为动物体内存在一种生命力(Vital Force)——一种“animus”,它赋予了生物独特的特性。如今我们知道,生物体中不存在任何违反化学或物理定律的现象。
然而,生命的化学确实具有特殊性。
- 生命依赖于发生在水溶液中的化学反应,并且主要基于碳化合物——这些化合物的研究被称为有机化学。
- 尽管细胞含有多种小型含碳分子,但大部分碳原子都被整合进巨大聚合分子中——由化学单元首尾相连形成的长链。这些大分子的独特性质,使细胞和生物能够生长、繁殖,并完成所有生命特有的功能。
- 细胞化学极其复杂:即使是最简单的细胞,其化学系统也远比已知的任何其他化学体系复杂得多。我们现在认识到,细胞中众多相互关联的化学反应网络能够产生所谓的涌现特性(emergent properties),理解这些特性需要发展新的实验和计算方法。
生物体仅由少量元素构成
生物体仅由 92 种天然存在的元素中的一小部分构成,其中四种——碳 ©、氢 (H)、氮 (N) 和氧 (O)——占据了生物体质量的 96.5%。
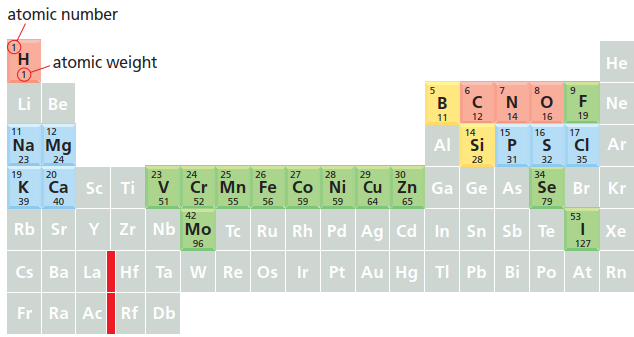
《Molecular Biology of the Cell》7E, Fig. 2-1
图中红色标出的四种元素占据了人体原子总数的 99%(质量占 96.5%)。另有蓝色标出的七种元素,合计约占人体原子总数的 0.9%。绿色标出的元素是人体所需的微量元素。黄色标出的元素是否对人体必需,目前尚不清楚。
四种类型的非共价作用力帮助细胞内分子结合
生物学中的许多过程依赖于不同分子之间的特异性结合,这种结合由三类非共价键驱动:氢键、静电吸引(离子键)和范德华力,再加上一种可以推动分子聚集的作用力:疏水效应。
由于水分子会与这些分子形成竞争性的相互作用,因此在细胞内部,静电吸引和氢键的强度会大大削弱。
Table 2-1 Covalent and Noncovalent Chemical Bonds
| Bond type | Length (nm) | Strength (kJ/mole**) In vacuum | Strength (kJ/mole**) In water |
|---|
| Covalent | 0.10 | 377 | 377 |
| Noncovalent | | | |
| Ionic | 0.25 | 335 | 12.6 |
| Hydrogen | 0.17 | 16.7 | 4.2 |
| van der Waals attraction (per atom) | 0.35 | 0.4 | 0.4 |
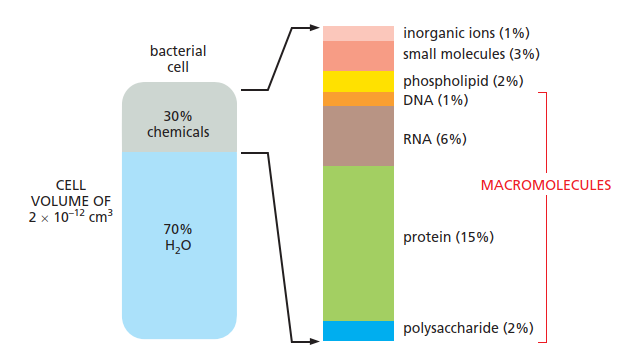
《Molecular Biology of the Cell》7E, Figure 2–7 细胞中分子的分布
图中显示了一个细菌细胞按重量计算的近似成分。尽管动物细胞的体积大约大 1000 倍,但其组成与细菌细胞相似。
高分子占据主导地位。主要的无机离子包括 Na⁺、K⁺、Mg²⁺、Ca²⁺ 和 Cl⁻。
细胞代谢由酶组织
细胞所进行的化学反应,若在没有帮助的情况下,通常只有在远高于细胞内部温度的条件下才能以相当快的速度进行。正因为如此,每一个反应都需要特定的化学活性“推动”。这种需求至关重要,因为它使细胞能够控制自身的化学过程。这种控制通过特殊的生物催化剂来实现。这些催化剂几乎总是蛋白质,称为酶,但也存在由 RNA 构成的催化剂,称为核酶(ribozyme)。
每一种酶仅能加速或催化某一种特定类型的反应,而这种反应是某个分子在诸多可能的化学变化中能发生的一种。酶催化的反应彼此相连,使得一个反应的产物成为下一个反应的起始物质或底物。这些长的线性反应途径又彼此连接,形成复杂的反应网络,使细胞能够生存、增长和繁殖。
在细胞中,存在两条方向相反的化学反应流:
分解代谢(catabolic pathways) ——将食物分解为更小的分子,从而既产生了细胞所需的能量,又提供了某些作为构件的小分子;
合成代谢(anabolic 或 biosynthetic pathways) ——利用分解代谢产生的小分子以及其中获取的能量,驱动细胞所需的各种大分子的合成。
这两类反应共同构成了细胞的代谢(metabolism)。
细胞如何从环境中获取能量并利用这些能量维持内部的有序性,这是细胞生物学的基本问题。
细胞释放热能使生物有序成为可能
事物趋向无序是一条普遍规律,即热力学第二定律。它指出,在宇宙或任何孤立系统(与宇宙其他部分完全隔绝的物质集合)中,无序的程度总是不断增加。这条定律对生命有着极其深远的意义,因此我们会用多种方式反复强调它。
例如,我们可以从概率角度重新表述第二定律:系统会自发地向最可能出现的状态转变。设想一个盒子中有 100 枚硬币,全都朝上。一系列意外的扰动会使硬币的排列逐渐趋向一半正面、一半反面。原因很简单:实现 50:50 混合的排列方式有极其庞大的数量,而保持所有硬币都朝上的排列方式却只有一种。由于 50:50 混合更可能发生,我们就说它更加“无序”。
系统中的无序程度可以量化,用熵(entropy)来表示:无序越大,熵越大。因此,第二定律也可以表述为:系统会自发地向熵更大的状态转变。
那么,活细胞通过生存、生长并形成复杂的有机体,实际上是在不断产生有序,似乎违反了热力学第二定律。这是如何可能的呢?答案在于:细胞并不是一个孤立系统。它从环境中获取能量——要么来自食物中化学键的能量,要么来自太阳的光子(甚至在一些化能合成细菌中,能量来源仅是无机分子)。细胞利用这些能量在自身内部产生有序。关键在于:在生成有序的化学反应过程中,细胞会将部分能量转化为热能。这些热能释放到细胞周围环境,增加了环境的无序。结果是:细胞加上环境的总熵仍然增加,完全符合热力学第二定律。
为了理解这些能量转化的原理,可以把细胞想象成漂浮在“物质之海”中的一个小岛。当细胞生长并建立内部的有序结构时,它不断释放热能。这些热量实际上是能量最无序的形式——分子的随机热运动。当热量传递到“物质之海”中时,会增加那里的分子运动强度(即热运动),从而提高外部的无序程度。正因如此,细胞内部秩序的增加总是伴随着周围环境更大幅度的无序增加(熵增),所以热力学第二定律得以满足。
那么,细胞释放的热量究竟来自哪里?热力学第一定律指出:能量可以从一种形式转变为另一种形式,但不能被创造或消灭。图 2–17 展示了几种能量形式的相互转化。细胞内的化学反应会改变不同形式能量的分布,但总能量保持不变。例如,动物细胞摄取食物,将其中化学键的能量转化为分子的随机热运动(热能)——正是这种热量维持了我们的体温。
细胞不能直接利用释放的热能,除非产热反应与分子有序生成过程紧密耦合。
细胞通过有机分子的氧化获得能量
所有动植物细胞的能量来源,都是储存在有机分子化学键中的能量。对于植物来说,这些有机分子是它们通过光合作用合成、作为自身食物的糖类;对于动物来说,则是它们摄取的大小分子混合物。不论哪种情况,生物体都必须将这些能量以可利用的形式提取出来,才能生存、生长和繁殖。无论在植物还是动物中,能量的提取都通过逐步氧化的过程实现,也可称为受控燃烧。
地球大气中含有大量氧气,而在氧气存在的条件下,碳最稳定的能量形式是二氧化碳(CO₂),氢最稳定的能量形式是水(H₂O)。因此,细胞能够通过使糖类或其他有机分子中的碳原子和氢原子分别与氧气结合,生成 CO₂ 和 H₂O,从而获得能量——这一过程称为有氧呼吸。
光合作用与呼吸作用是互补的过程。这意味着植物与动物之间的物质交换并不是单向的。在地球上,植物、动物和微生物共同存在了如此漫长的时间,以至于它们彼此已成为对方环境中不可或缺的一部分。光合作用释放出的氧气,会在有机分子进行有氧呼吸的燃烧过程中被消耗。而今天被绿色叶片通过光合作用固定成有机分子的某些 CO₂ 分子,可能正是昨天由动物的呼吸作用释放到大气中的,或者是由真菌或细菌分解死亡有机物时释放出来的。
因此,我们可以看到,碳的利用构成了一个涉及整个生物圈(地球上所有生物)的巨大循环。类似地,氮、磷和硫的原子也在植物、藻类、动物、真菌和细菌之间不断循环,在生物界与非生物界之间来回转移。
酶能够引导底物分子沿特定的反应途径前进
酶无法改变化学反应的平衡点。原因很简单:当酶(或任何催化剂)降低反应 Y → X 的活化能时,它必然也会以完全相同的幅度降低逆反应 X → Y 的活化能。因此,酶会以同样的倍数加速正反两个方向的反应,而反应的平衡点不会改变。换句话说,无论酶将反应加快多少倍,它都不能改变反应的方向。
尽管存在这一限制,酶仍然能够将细胞中的所有反应引导至特定的反应路径。这是因为酶高度专一且极为精确,通常只催化一种特定反应。换句话说,每种酶仅选择性地降低它所结合的底物分子在几种可能的化学反应中某一个的活化能。通过这种方式,一组组酶就能够引导细胞中的不同分子沿着特定的反应途径前进。
生物体的成功正是依赖于细胞制造出大量具有精确特性的不同比例的酶。每个酶都有一个独特的形状,其中包含一个 活性位点,这是酶上的一个口袋或沟槽,只能容纳特定的底物。像所有其他催化剂一样,酶分子在反应过程中本身不会发生改变,因此可以反复使用。
反应的自由能变化(ΔG)决定它是否能自发发生
虽然酶能加快反应速率,但它们本身无法使能量上不利的反应发生。然而,细胞必须做到这一点才能生长和分裂:它们必须从小而简单的分子中构建高度有序、富含能量的分子。细胞通过直接耦合两类反应来实现这一点——将释放能量并产生热量的有利反应与需要能量、产生生物有序性的反应相连。
“能量上有利(energetically favorable)”到底是什么意思?我们又如何对其进行定量描述呢?
根据热力学第二定律,宇宙倾向于向最大无序(即最大熵或最高概率)发展。因此,一个化学反应只有在导致宇宙的无序度净增加时,才能自发进行。这种宇宙无序的变化最方便地可以用系统的自由能(free energy, G)来表示。
自由能 G 表示系统中可用于做功的能量,例如推动化学反应的能量。G 的数值只有在系统发生变化时才有意义。反应的自由能变化,记作 ΔG(delta G),是关键参数,因为正如图 2–7 所解释的那样,它直接反映了一个反应发生时宇宙中无序增加的程度。
按定义,能量上有利的反应是那些使自由能降低(ΔG 为负)的反应;换句话说,这些反应增加了宇宙的无序度。
例如,在宏观层面上,一个被压缩的弹簧释放储存的弹性能并恢复至伸展状态、将热能散发到周围环境的过程,就是一个能量上有利的反应;在微观层面上,食盐溶解于水中也是类似的例子。
相反,能量上不利的反应(ΔG 为正)——例如将两个氨基酸连接形成一个肽键——本身会增加体系的有序度,因此不能自发发生。这类反应只有在与另一个 ΔG 为负、能量释放足够大的反应相偶联(coupled)时,才有可能进行;也就是说,整个过程的总 ΔG 必须为负。
反应物浓度影响自由能变化及反应方向
当反应的自由能变化(ΔG)为负时,反应 Y ↔ X 会朝 Y → X 的方向进行,就像一根被拉伸的弹簧在释放时会恢复到原状,并将储存的能量以热的形式散发到周围一样。
然而,对于化学反应而言,ΔG 不仅取决于每个分子自身储存的能量,还取决于反应混合物中各分子的浓度。
请记住,ΔG 反映的是一个反应在多大程度上创造出更无序(即更可能)的宇宙状态。
“硬币类比”:如果一个装有 90 个正面、10 个反面的盒子被轻轻摇动,那么一个硬币从正面翻到反面的概率非常大;
但如果盒子里已经有 90 个反面、10 个正面,那么再出现一次“正面翻反面”的概率就会小得多。
化学反应的情况与此类似。对于一个可逆反应 Y ↔ X,如果体系中 Y 的浓度远高于 X,那么反应就倾向于朝 Y → X 方向进行。
因此,随着 Y/X 比值的增大,Y → X 方向的 ΔG 会变得更负(而 X → Y 的 ΔG 会变得更正)。
要让反应的浓度差抵消由化学键能降低(以及伴随的热释放)所产生的能量变化,究竟需要多大的浓度差?
这一点并不直观。
在 19 世纪晚期,科学家们通过热力学分析确定了这种关系,并由此能够将自由能变化中与浓度有关的部分与与浓度无关的部分分离开来。
标准自由能变化(ΔG°)使我们能够比较不同反应的能量学特性
由于 ΔG 取决于反应混合物中各分子在任意时刻的浓度,因此它并不是一个特别有用的数值来比较不同类型反应的相对能量。为了在可比较的基础上讨论反应,我们需要使用反应的标准自由能变化(ΔG°)。
ΔG° 是指在标准条件下的自由能变化,标准条件定义为:所有反应物的浓度均固定为 1 摩尔/升(1 M)。在这种定义下,ΔG° 仅取决于反应分子的内在性质。
对于一个简单的反应 Y → X(在 37°C 下),ΔG° 与 ΔG 的关系如下:
\Delta G = \Delta G^\circ + RT \ln \frac{[X]}{[Y]}
其中:
大量的热力学数据已经被收集,使我们能够确定细胞中重要代谢反应的标准自由能变化 ΔG°。借助这些 ΔG° 值,并结合代谢物浓度及反应途径的额外信息,我们就可以定量地预测大多数生物反应的进程。
平衡常数与 ΔG° 可以相互推导
从上面的公式可以看出,当产物 X 和反应物 Y 的浓度相等时,ΔG 与 ΔG° 相等。
但在任何有利的反应进行时,产物浓度会增加,而底物浓度会减少。这种相对浓度的变化会导致 [X]/[Y] 越来越大,使最初有利的 ΔG 变得越来越不负。
最终,当 ΔG = 0 时,反应达到化学平衡。此时系统中不存在净自由能变化来驱动反应向任意方向进行,因为浓度效应恰好抵消了 ΔG° 提供的推动力。
我们可以为反应 Y → X 定义其平衡常数 K:
K = \frac{[X]}{[Y]}
由公式 ΔG = ΔG° + RT ln([X]/[Y]) 并考虑在平衡状态下 ΔG = 0,可得:
\Delta G^\circ = -RT \ln \frac{[X]}{[Y]} = -RT \ln K
在 37°C(此时 RT = 2.58)时,平衡方程为:
\Delta G^\circ = -2.58 \ln K
将自然对数转换为常用对数(log)形式:
\Delta G^\circ = -5.94 \log K
更一般地,对于一个有多个反应物和产物的反应,例如 A + B → C + D:
K = \frac{[C][D]}{[A][B]}
于是,在 37°C 下:
\Delta G^\circ = -5.94 \log \frac{[C][D]}{[A][B]}
其中 ΔG° 的单位为千焦/摩尔(kJ/mol),而 [A]、[B]、[C]和 [D] 分别表示反应物和产物的浓度(单位:mol/L)。
表 标准自由能变化 ΔG° 与平衡常数的关系
| 平衡常数 ( [X]/[Y] = K ) | X 的自由能减去 Y 的自由能 [kJ/mol] |
|---|
| 105 | –29.7 |
| 104 | –23.8 |
| 103 | –17.8 |
| 102 | –11.9 |
| 101 | –5.9 |
| 1 | 0 |
| 10-1 | 5.9 |
| 10-2 | 11.9 |
| 10-3 | 17.8 |
| 10-4 | 23.8 |
| 10-5 | 29.7 |
耦合反应的自由能变化是可加的
我们已经指出,不利的反应可以与有利的反应耦合,从而推动不利反应向前进行。从热力学角度来看,这是可能的,因为一系列耦合反应的总体自由能变化等于其各组成步骤自由能变化的总和。
举一个简单例子,考虑两个连续反应:
X → Y 和 Y → Z
它们的 ΔG° 值分别为 +5 kJ/mol 和 –13 kJ/mol。如果这两个反应顺序发生,那么耦合反应的 ΔG° 将为 –8 kJ/mol。
这意味着,在适当条件下,不利的反应 X → Y 可以被有利的反应 Y → Z 驱动,前提是第二个反应紧跟第一个反应发生。例如,将糖转化为 CO₂ 和 H₂O 的长途代谢途径中,有些反应的 ΔG° 为正值,但整个途径仍能进行,因为连续反应序列的总 ΔG° 为一个较大的负值。
然而,仅仅形成一个连续的反应途径在很多情况下并不足够。通常,我们希望的途径只是 X → Y,而不希望 Y 再进一步转化为其他产物。幸运的是,还有其他更通用的方法可以利用酶来耦合反应。为了说明这是如何实现的,我们需要引入下文讨论的 活化载体分子。
活化载体分子是生物合成必不可少的
为了生命的进行,食物分子氧化释放的能量必须先暂时储存,然后才能用于构建细胞所需的众多其他分子。在大多数情况下,这些能量以化学键能的形式储存在一小类活化的“载体分子”中,这些分子含有一个或多个富含能量的共价键。这些分子能够快速扩散到整个细胞,从能量产生部位将其键能运输到能量将被用于生物合成及其他细胞活动的部位。
活化载体以一种易于交换的形式储存能量,要么是可迅速转移的化学基团,要么是处于高能级的电子,并且它们在生物合成反应中可以同时充当能量和化学基团的来源。出于历史原因,这些分子有时也被称为辅酶。
最重要的活化载体分子是ATP,以及两种密切相关的分子NADH和NADPH。
耦合反应不仅使细胞能够生成这些活化载体分子,还能像使用货币一样利用它们来支付那些否则无法进行的反应的“费用”。
活化载体的形成与能量有利的反应耦合
耦合机制需要酶,并且是细胞所有能量交易的基础。酶将能量有利的反应(如食物氧化)耦合到能量不利的反应(如活化载体分子的生成)。氧化反应释放的热量减少了,正好等于储存在活化载体分子高能共价键中的能量。活化载体分子获取一份能量包,这个能量足以在细胞的其他部位驱动化学反应。